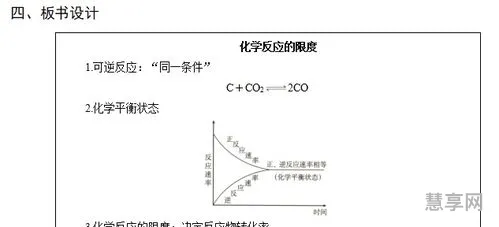
化学平衡常数(化学平衡k值计算公式)
化学平衡常数
kh值的大小是由发生水解的离子的*质与温度共同决定的;温度一定时,离子水解能力越强,kh值越大;温度升高时,kh值增大;对于多元弱**离子或多元弱碱阳离子来说,其kh1kh2kh3。
式中k、cl、o各出现一次,只有氧原子数两边不等,左边3个,右边2个,所以应从氧原子入手来开始配平。由于3和2的最小公倍数是6,6与kclo3中氧原子个数3之比为2,所以kclo3系数应为2。又由于6跟o2的氧原子个数2之比为3,所以o2系数应为3。配平后的化学方程式为:

首先找出左、右两边出现次数较多,并且一边为单数,另一边为双数的原子(氧原子)。由于氧分子是双原子分子o2,生成物里氧原子总数必然是双数,所以h2o的系数应该是2(系数应该是最简正整数比),如下式中1所示:
fe2(so4)3所含原子数最多、最复杂,其中三个so4进入na2so4,每个na2so4含有一个so4,所以na2so4系数为3;2个铁原子fe需进入2个fe(oh)3,所以fe(oh)3系数为2,这样就得到:
基本思路:严格按照新定义的运算规则,把已知的数代入,转化为加减乘除的运算,然后按照基本运算过程、规律进行运算。
化学平衡k值计算公式
基本概念:一定量的对象,按照某种标准分组,产生一种结果:按照另一种标准分组,又产生一种结果,由于分组的标准不同,造成结果的差异,由它们的关系求对象分组的组数或对象的总量.
测定ph最简便的方法是使用ph试纸。即把待测溶液滴在ph试纸上,然后把试纸显示的颜*跟标准比*卡对照。这样便可知道溶液的ph。如果要精确地测定溶液的ph,可以采用测量ph的仪器(参看*碱指示剂、ph试纸的使用)。
同一电解质,k值只与温度有关,一般情况下,温度越高,k值越大;此外对于多元弱*来说,其ka1ka2ka3。
【化合物】由不同种元素组成的纯净物。如水h2o,高锰*钾kclo3、五水硫*铜cuso4?5h2o等都是化合物。
【化学方程式的配平】在化学方程式各化学式的前面配上适当的系数,使式子左、右两边每一种元素的原子总数相等。这个过程叫做化学方程式配平。
ka kh kb kw化学表达式
基本思路:假设每头牛吃草的速度为“1”份,根据两次不同的吃法,求出其中的总草量的差;再找出造成这种差异的原因,即可确定草的生长速度和总草量。
应该注意化学变化和化学*质的区别,如蜡烛燃烧是化学变化;蜡烛能够燃烧是它的化学*质。物质的化学*质由它的结构决定,而物质的结构又可以通过它的化学*质反映出来。物质的用途由它的*质决定。
如可燃*、不稳定*、**、碱*、氧化*、还原*、跟某些物质起反应等。用使物质发生化学反应的方法可以得知物质的化学*质。例如,加热kclo3,可以生成使带火星的木条复燃的气体,表明kclo3受热达较高温度时,能够放出o2。因此kclo3具有受热分解产生o2的化学*质。