金属及其化合物(常见的金属化合物有哪些)
金属及其化合物
有色合金是以一种有色金属为基体(通常大于50%),加入一种或几种其他元素而构成的合金。有色金属通常指除去铁(有时也除去锰和铬)和
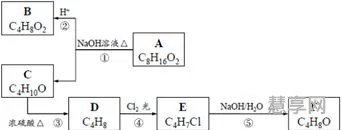
(3)如何除去FeCl3溶液中的FeCl2?如何除去FeCl2溶液中的FeCl3?写出有关反应的离子方程式。
说明Fe具有还原性,Fe遇稀*或*铜反应生成*亚铁,Fe遇稀硝酸反应生成硝酸铁。有关转化反应的离子方程式:
(8)取少量的酸性KMnO4溶液、稀HNO3、Na2O2分装三支*中,分别滴加FeSO4溶液,并振荡*,观察到的实验现象分别是什么?写出有关反应的离子方程式。
向*中加入少量氯化铁(或氯化亚锡)固体,注入适量蒸馏水,振荡*,观察发生的现象。然后再加入一定量的盐酸,振荡*,观察发生的现象。
常见的金属化合物有哪些
少量氯化亚锡溶于适量蒸馏水,溶液中产生白色沉淀,再加入一定量的盐酸,白色沉淀溶解。SnCl2+H2O=Sn(OH)Cl↓+HCl,因水解而导致溶液中生成沉淀。
(8)金属镁与氯化铁溶液反应时,有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀。为什么会有这些现象发生?
1氧化性比亚铁离子强的氧化剂都能实现“Fe2+→Fe3+”的转化,Fe2+在转化中显还原性。如:Cl2、Br2、O2等非金属单质;稀HNO3、浓HNO3、浓H2SO4等氧化性酸;KMnO4、K2Cr2O7、H2O2、Na2O2等其他氧化剂。
(6)在FeCl3和CuCl2的混合液中,加入一定量的Fe粉,完全反应后,溶液中一定有的金属阳离子是什么?如果反应后有固体剩余,则溶液中一定没有的离子是什么?一定有的金属
(2)Fe2+既不能在碱性条件下稳定存在,也不能在空气中稳定存在的,那么在酸性和中性两种情况下,FeSO4溶液被氧气O2氧化的离子方程式如何书写?
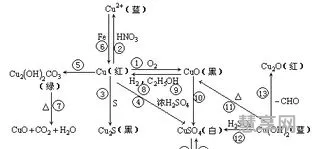
高中化学铁及其化合物知识点
向盛有FeSO4溶液的*中,滴加KSCN溶液,溶液不显红色,再向*中滴加几滴新制的氯水(或双氧水),并振荡*,观察实验现象。
2+2价铁的化合物溶液与Mg、Al、Zn等强还原剂,或+2价铁的固体化合物在高温下与H2、CO、碳、铝等起反应时,被还原成单质铁,反应中+2价铁的化合物显氧化性。
(1)用FeSO4溶液和NaOH溶液制取Fe(OH)2时,为什么滴管可以伸入到液面以下?为什么制备FeSO4溶液要用煮沸过的蒸馏水?为什么要用新煮沸过的NaOH溶液?
2Fe与强氧化剂(如Cl2、F2、Br2、稀HNO3、热浓HNO3、热浓H2SO4等)反应时生成+3价的化合物。
实验探究三:探究Fe2+既有还原性又有氧化性,并实现“Fe2+→Fe3+与Fe2+→Fe”的转化。